관찰감시를 요하는 저위험신생아의 생후 초기 혈당변이 탐색
Glucose Variations in the First Day of Life of Newborns under Observational Surveillance
Article information
Trans Abstract
Purpose
Nursing protocols for glucose management are well known for both healthy term newborns and high-risk newborns. However, for less risky newborns who are under only observation surveillance, hypoglycemia could be overlooked unless clinical symptoms develop.
Methods
A retrospective study was performed to explore factors influencing variations in glucose levels in 91 newborns who did not require any interventions, but were under nursing surveillance, at a level II neonatal intensive care unit. Data were retrieved from electrical medical records on glucose levels, demographic characteristics, and other clinical characteristics of newborns in their first day of life from January 2016 to May 2019.
Results
Glucose levels tended to stabilize within the normal range (60~80 mg/dL) as time passed during the first day of life. Cesarean section, multiple gestation, abnormal growth, and later preterm birth were associated with low glucose levels in the first 2 hours of life. Thirty-one newborns experienced a hypoglycemic episode (< 45 mg/dL) during the first 24 hours of life.
Conclusion
The findings of this study support the active encouragement of early feeding within 2 hours of birth and urgent adoption of a structural protocol for glucose surveillance in newborns with potential health problems immediately after birth.
서 론
1. 연구의 필요성
태아는 성장과 대사에 필요한 모든 영양을 모체로부터 공급받으며 이들의 혈중 포도당 농도는 모체보다 약 10 mg/dL 정도 낮은 범위에서 균일하게 유지된다[1]. 그러나 출생과 동시에 태반을 통한 포도당 공급이 급격히 중단되고 생후 첫 1~2시간 동안 신생아는 25 mg/dL 이하로 매우 낮은 혈당 수준에 이르는 일시적 저혈당 상태를 보일 수 있다[2]. 이는 포도당 및 대체물질의 소비-공급 간 일시적 불균형으로 정상 만삭아의 12.1%[3], 후기조산아의 34%[4]에서 흔히 관찰된다. 그러나 태내 성장발달과 출생과정이 정상적이며 호흡, 체온 등 생후 초기 생리상태가 안정적이고 수유를 통해 영양을 공급받는 신생아의 경우, 포도당신합성, 케톤합성과 같은 에너지 대사과정이 효율적으로 작동됨에 따라 혈당값이 생후 2일 이내에 60~70 mg/dL로 안정된다[2].
일반적으로 영양공급이 부족할 때 대응하는 호르몬 작용, 포도당 외의 연료를 사용하는 능력, 선행된 저혈당의 빈도 등은 개인에 따라 상이하므로 저혈당을 발생 초기부터 즉각 특정하고 인지하기는 쉽지 않다[5]. 신생아의 저혈당은 초기에 대부분 무증상이지만 위험요인이 지속되거나 예방적 중재를 제공받지 않으면 임상적 증상이 발현한 후에 저혈당을 감지하게 된다[6,7]. 흔히 알려진 저혈당의 증상은 발한, 창백, 체온불안정, 빈맥 등인데 이때의 혈당값은 약 30 mg/dL 이하로 이미 상당히 낮은 수준이며[8], 저혈당의 정도나 기간이 심화되면 근긴장 저하, 경련, 의식변화 등 뇌 손상 가능성이 있는 신경 저혈당성 증상이 나타날 수 있다[9,10]. 건강한 신생아의 경우에는 출생 직후부터 적극적 수유가 가능하여 저혈당이 심각한 수준에 이르지는 않지만 생후 초기 적응에 어려움이 있는 신생아의 경우 수유 지연이나 불균형으로 인해 혈당이 상당히 낮은 수준에 이르거나 급격히 증가하고 감소하는 현상을 보인다[11]. 혈당값이 낮거나 높은 문제뿐 아니라 불안정하게 요동하는 현상역시 뇌신경학적 손상의 위험을 가중시키므로 간호사는 신생아가 특별한 증상을 보이지 않더라도 생후 초기 수유양상, 생리적 적응 및 혈당 변화를 민감하게 감시하고, 저혈당 발생 시 신속하고 효과적으로 관리하는 것이 매우 중요하다[12].
American Academy of Pediatrics (AAP)와 Pediatric Endocrine Society (PES)는 생후 초기 저혈당을 적극적으로 감시하고 관리해야 하는 저혈당 고위험군으로 조산아, 부당경량아, 당뇨병산모 아기와 저체온증이나 심한 통증과 같은 스트레스 상태의 아기, 영양흡수장애나 감염과 같은 병리적 상태를 가진 아기를 적시하였다[6,7]. AAP와 PES의 혈당관리지침에 의하면 저혈당 위험이 있는 신생아의 경우 출생 후 30분에서 1시간 이내에 수유를 시작하고, 첫 수유 후에도 혈당값을 측정하도록 권고하고 있다. 저혈당 관련 기저질환이 없고 정상 태내발달을 통해 정상 출생한 건강한 신생아의 경우, 생후 수일 내에 성공적인 수유 적응 양상이 보이고 저혈당 증상이 관찰되지 않으면 규칙적으로 혈당값을 측정할 필요는 없다고 제시하였다[12,13]. 즉 현재 임상실무에서는 고위험신생아를 제외하고는 생후 초기 혈당적응을 평가할 수 있는 지침은 찾아보기 어렵다.
그러나 적극적 혈당관리의 대상인 고위험신생아와 규칙적인 혈당측정이 필요하지 않은 건강한 만삭아 사이에 저혈당 감시 측면에서의 사각지대에 있는 저위험집단이 있을 수 있다. 예를 들어 특정 병리문제 없이 후기조산(late preterm) 또는 경미한 난산이거나 모체 내에서 당뇨나 고혈압에 노출된 신생아는 일시적 수유 지연과 불안정한 생리상태를 보일 수 있다[14]. 이들은 심각한 건강문제가 잠재되어 있을 수도 있고 빨기-삼키기-호흡의 협응과정이 아직 불안정하거나 출산 직후 모유량이 충분하지 않을 수 있음에 따라, 여전히 저혈당이 발현할 가능성이 큰 대상이다[15]. 그럼에도 불구하고 특별한 병리적 특성이 발현되지 않는 한, 이들은 혈당감시를 위한 고위험군에 속하지 않기 때문에 이들의 생후 초기 저혈당 위험성은 간과될 수 있다. 혈당이 생후 초기 수시간 동안은 낮은 수준을 보일지라도 생후 둘째 날에는 60~70 mg/dL 수준에서 안정되어야 하는데[2,3], 그 과정에서 적절한 상승을 보이지 못하거나 급격한 변동과 같은 부적응이 있을 경우 간호사는 병리적 증상으로 발현된 후에야 이를 관찰하고 문제를 확인한다. 따라서 간호사는 이들을 정상신생아와 고위험신생아 사이에 있는 저위험신생아로 적시하여 이들의 혈당적응이 바람직한 패턴으로 이루어질 수 있도록 신중하게 구강수유를 격려하고 적극적으로 혈당을 감시할 필요가 있다. 이를 위해서는 이들의 생후 초기 혈당적응 패턴과 영향요인 탐색이 선행되어야 하나 혈당변이에 대한 연구는 대부분 건강한 만삭아 집단에만 국한되어 있으며[5,16], 저위험신생아의 경우 단순히 저혈당 발현 가능성이 어느 정도인지에 대한 연구가 주를 이루고 있어[3,17] 혈당변이에 영향을 주는 요인을 탐색하거나 이들의 상호작용을 탐색하는 자료는 매우 제한적이다.
2. 연구 목적
본 연구는 병리적 문제를 가지고 있지는 않으나 생후 초기 불안정한 적응 상태로 인해 적극적 관찰감시를 요하는 신생아를 저위험신생아군으로 명명하여, 이들의 생후 초기 혈당변이와 관련 요인을 탐색하기 위해 수행되었다. 이와 같이 특이한 증상을 발현하지 않는 신생아가 생후 초기에 경험하는 혈당변이에 대한 이해는 생후 초기적응과 관련된 적절한 수유공급과 저혈당 예방을 위한 실무의 기초자료를 제공할 것이며 구체적인 목표는 다음과 같다.
저위험신생아의 특성에 따른 생후 첫 24시간 혈당변이를 분석한다.
저위험신생아의 저혈당 발생에 영향을 미치는 요인을 탐색한다.
연구 방법
1. 연구 설계
본 연구는 기존 의무기록을 이용하여 저위험신생아군의 생후 24시간 혈당 양상을 검토하고 혈당변이에 영향을 미치는 대상자특성을 분석하는 후향적 코호트 탐색연구이다.
2. 연구 대상
연구의 대상자는 생후 24시간 동안 특정 병리증상의 발현 또는 적극적 치료를 요하는 질환을 가지고 있지는 않으나 생후 초기 적극적 관찰감시를 요하는 신생아였다. 구체적인 선택조건은 재태기간 34주 이후의 후기조산 출생아 중 생후 초기 5분 아프가 점수가 7점 이상이고 생후 첫날 구강수유 중이면서 산소포화도 모니터링과 혈당측정값을 가지고 있는 신생아였다. 제외조건은 질환이나 비정상적 임상증상을 있는 경우, 타 기관으로부터 전원, 태내발달지연, 정맥이나 위관을 통한 영양공급, 약물치료(스테로이드, 항생제, 인슐린 등), 신생아실에서의 산소투여, 36℃ 미만의 저체온, 분당 160회 이상의 빈맥 등이었는데 이는 이미 혈당을 포함한 대사에 영향을 주는 고위험 조건이기 때문이었다. 분만실에서의 일시적 산소투여, 자발적으로 회복되는 3회/일 이하의 무호흡, 모체의 임신출산 관련 질환(예: 전치태반)과 같은 특별한 처치 없이 임상적 관찰감시를 요하는 상태는 저위험조건에 해당하므로 제외조건에 포함하지 않았다.
표본크기는 신생아저혈당 빈도를 참고로 산출되었는데, 재태기간 42주 이하 신생아 집단에서 26.5%이고 38주 이하 집단에서는 40%임을 이용하여 계산한 결과[18] 유의수준 5%, 검정력 80%에서 90명의 표본크기가 산출되었다. 본 연구의 대상자 선정기준에 부합하는 신생아는 연간 약 30명인 것으로 파악되어 2016년 1월 1일부터 2019년 5월 31일까지 3년 반 동안 입원한 신생아의 의무기록을 검토하였고 위 조건에 부합한 91명을 저위험신생아 코호트 대상으로 포함하였다.
3. 자료 수집 방법 및 절차
본 연구의 자료 수집은 기관생명윤리위원회 승인(IRB No. 2019-04-005)을 득한 후 코호트 의무기록의 후향적 검토를 통해 진행하였다. 자료 수집을 위해 연구팀은 수차례 논의와 사전연구를 통해 구조화된 자료 수집지와 코딩룰을 개발하였다. 자료 수집은 신생아집중치료실 경력 5년 이상의 연구원 3인이 코호트 대상자의 의무기록을 후향적으로 검토하면서 진행하였는데, 수집자 간 자료 해석의 차이가 있는 경우 수차례 논의와 상호교차 검토를 통해 일치를 보았다.
수집변수는 신생아의 혈당변이에 영향을 미칠 것으로 예상되는 일반적 특성, 임상 특성, 구강수유 양상과 혈당값이었다. 일반적 특성은 성별, 출생 방법, 재태기간, 출생 체중, 아프가 점수를 수집하였으며, 혈당에 영향을 줄 수 있는 임상 특성은 문헌고찰을 통해 확인된 태내 및 출생력(태아가사, 경미한 태변착색 등), 활력징후, 구강수유, 호흡불안정(일회성 느린 호흡, 일회성 산소 투여), 위장계 증상(일시적 역류나 빨기 어려움), 모체건강문제(당뇨, 고혈압, 갑상선질환, 성매개질환 등)를 수집하였다[2,3]. 구강수유 자료는 수유 형태, 수유 시간, 수유량을 수집하였다. 다만 모유수유아의 경우 정확한 수유량을 파악할 수 없으므로 수유 횟수를 파악하였다. 혈당값의 경우 혈장을 이용한 결과값을 기준으로 수집하였다.
4. 자료 분석 방법
수집된 자료는 분석을 위해 IBM SPSS/WIN 23 프로그램을 이용한 데이터 파일로 구축되었다. 생후 첫 24시간은 출생 후 경과시간에 따라 6단위(1: 출생~2시간 이내, 2: 2시간~4시간 이내, 3: 4시간~6시간 이내, 4: 6시간~12시간 이내, 5: 12시간~18시간 이내, 6: 18시간~24시간 이내)로 범주화한 후 이 범주에 맞추어 혈당값과 수유량을 재정렬하였다. 코호트 집단의 일반적 특성은 기술통계를 이용하여 분석하였고, 이들의 생후 첫 24시간 내 단순 혈당값 변이는 분산분석과 Tukey 사후 검증을 통해 분석하였다. 본 연구의 첫 번째 주요 목적인 혈당변이의 관련 요인 탐색은 이원 분산분석(two-way ANOVA)을 이용하여 일반적 특성, 임상 특성과 같은 잠재적 관련 요인과 시간에 따른 혈당변이 간의 상호작용을 파악하였다. 또한 두 번째 목적인 저혈당 관련 요인 탐색을 위해 본 연구에서는 혈당값이 45 mg/dL 보다 낮은 값을 보이는 자료를 저혈당이 발현한 것으로 간주하였으며[2], 저혈당 발현 여부에 따른 관련 요인 분석은 t-test 및 교차분석을 이용하였다. 통계적 유의수준은 5% 미만을 이용하였고, 다만 통계적으로 5% 이내의 유의성은 충족되지 않으나 근접한 유의수준 값을 보인 경우 임상적 중요성에 의미를 두고 결과를 해석하였다.
연구 결과
1. 일반적 특성
의무기록 검토를 통해 수집된 저위험신생아 코호트 대상자 91명 중, 여아가 53명(58.2%), 제왕절개 출생아가 64명(70.3%)이었으며, 출생 시 평균 재태기간은 37.1±1.7주, 체중은 2,891.9±581.1 gram이었다. 대상자 중 70명(76.9%)에게 태내기간이나 출생 시 혹은 생후 24시간 동안 일시적 건강문제가 발현했는데, 대상자의 최다빈도 문제는 후기조산(n=53), 호흡불안정(n=19), 고체온(n=11)순이었다. 고체온은 모두 37.7~38.0℃ 사이에서 나타났다. 모체가 건강문제를 가진 경우는 57명(62.6%)으로 임신성당뇨(n=31)와 고혈압(n=17)이 가장 다빈도를 보였다(Table 1).
2. 대상자 특성에 따른 생후 24시간 혈당변이
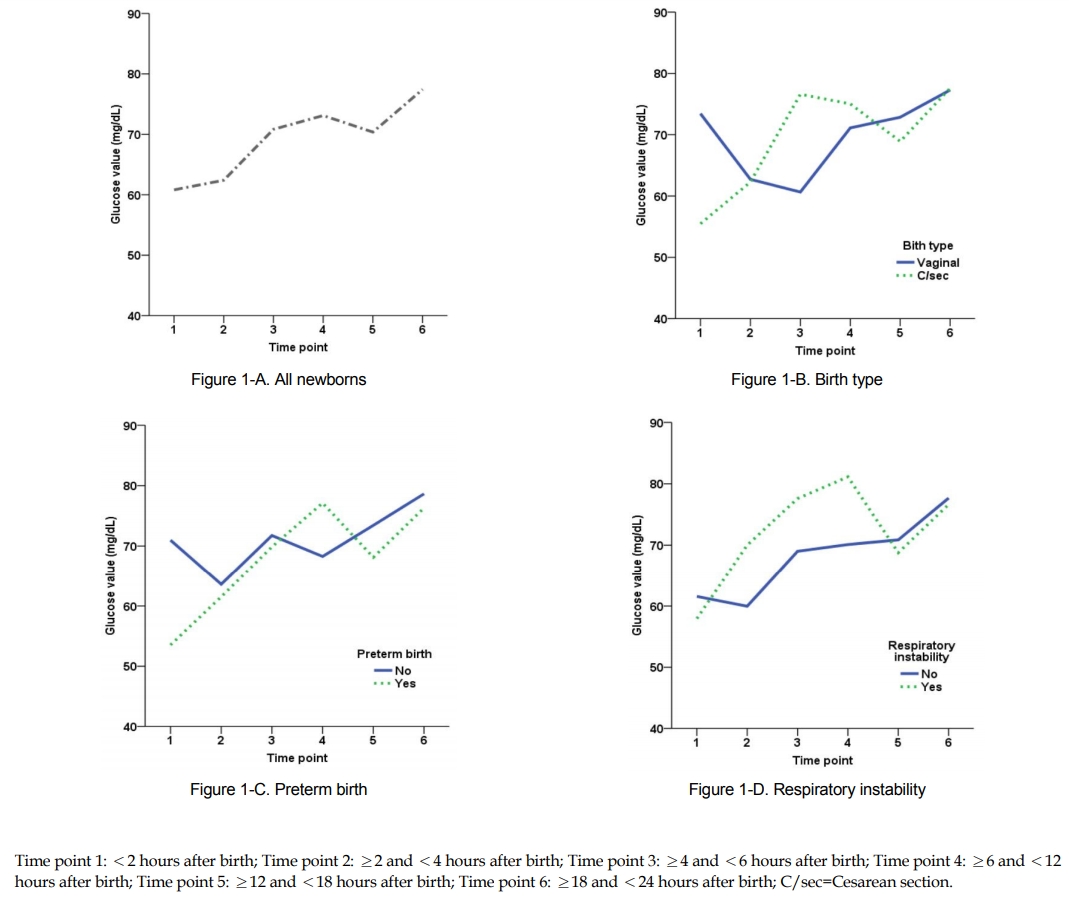
코호트 대상자의 생후 24시간 혈당 변이는 Table 2와 같다. 생후 2시간 이내 혈당값은 60.8±30.8 mg/dL이었으나 이후 시간이 경과함에 따라 유의하게 증가하여 생후 6시간 이후에는 73.1±13.8 mg/dL 수준에 이르렀다(Figure 1-A) (Table 2). 특히 사후 검증결과 생후 2시간과 4시간 이내에 측정한 값은 생후 18시간 이후에 측정한 값에 비해 유의한 수준으로 낮은 값을 보였다. 대상자의 출생 시 특성에 따른 혈당값을 탐색한 결과, 성별, 다태아, 적정출생 체중아(appropriate for gestational age, AGA), 저출생 체중아 여부는 생후 24시간 혈당값변이에 유의한 영향을 미치지 않았다. 그러나 여아, 제왕절개 출생아는 생후 2시간 이내에 60 mg/dL 이하로 낮은 수준을 보였으며 이후에는 60 mg/dL 이상으로 증가하였고, 다태아와 저출생 체중아의 경우 4시간 이후에 60 mg/dL 이상을 보였다. AGA에 속하지 않는 대상자는 AGA 대상자에 비해 생후 24시간 내내 지속적으로 낮은 혈당값을 보였다(F=13.35, p=.006). 특히 제왕절개 출생아는 정상분만아에 비해 생후 2시간 동안은 낮은 혈당값을 보였으며(t=6.86, p=.010) 이후에도 출생 방법과 시간 간 교호작용을 보였다(F=4.55, p<.001) (Figure 1-B)(Table 2).
코호트 대상자에게 관찰감시를 요하는 임상요인 즉 저위험요인 중 가장 최빈도를 보인 요인인 후기조산, 호흡불안정, 고체온, 첫 수유 시간, 모체의 당뇨와 고혈압 여부에 따라 생후 24시간 동안의 혈당변이를 살펴보았다. 그 결과 후기조산아와 만삭아의 생후 24시간 동안 혈당변이는 유의한 차이가 있었으며(F=3.22, p=.007), 특히 후기조산아는 생후 2시간 동안 평균 53.5±19.3 mg/dL의 낮은 혈당값을 보였다(Figure 1-C) (Table 3). 호흡불안정을 보인 대상자 역시 생후 2시간 동안 58.0±21.6 mg/dL로 낮은 수준의 혈당을 보였으며, 호흡불안정과 시간 간 유의한 교호작용을 보였다(F=2.47, p=.033) (Figure 1-D) (Table 3). 한편 고체온이 발현한 집단의 경우 지속적으로 정상체온을 유지한 집단과 비교하여 생후 24시간 혈당값 변이에 유의한 차이를 보이지 않았으며, 모체의 당뇨 역시 생후 24시간 혈당값 변이에 유의한 영향을 미치지 않았다. 그러나 모체고혈압을 경험한 집단과 반대 집단 간 생후 24시간 혈당변이는 서로 다른 양상을 보였다(F=2.16, p=.058) (Table 3).
3. 저혈당 발생 관련 요인
코호트 대상자 91명 중 생후 24시간 동안 45 mg/dL 이하의 혈당값을 보인 적이 있는 대상자는 모두 31명(34.1%)이었다. 이들을 저혈당 무경험과 유경험에 따라 나눈 후, 대상자의 일반적 특성과 다빈도를 보인 임상적 특성을 분석하였다. Table 4에 제시된 것과 같이 두 집단 간 혈당값은 각각 72.8±31.2 mg/dL와 37.6±10.0 mg/dL로 유의한 차이를 보였다(t=37.37, p<.001). 또한 여아에 비해 남아가(x2=3.31, p=.056), 고체온에 비해 정상체온일 때(x2=3.48, p=.057), 첫 수유를 2시간 이내에 한 경우(x2=5.66, p=.014) 저혈당 유경험 빈도가 높은 경향을 보였다. 그러나 두 집단 간 출생 시 재태 기간과 체중은 유의한 차이가 없었으며, 임상적 관찰감시를 요하는 임상상태 중 후기조산, 호흡불안정, 고체온, 모체의 당뇨와 고혈압도 저혈당 발생과 유의한 관계를 보이지 않았다.
논 의
신생아의 혈당적응은 모체로부터의 분리와 동시에 시작되는 생리적 적응 과정 중의 하나로 신생아가 자궁 외 환경에 안정적으로 적응하는지를 확인할 수 있는 지표이다. 고위험신생아의 혈당유지 및 저혈당 관리는 표준지침을 통해 매우 일관되고 철저히 관리되는 반면, 신생아가 특정 질환이나 병리증상을 보이지 않는 한 특별한 혈당관리를 하지 않는 게 일반적이다. 그러나 후기조산아와 같은 신생아는 비효율적 구강수유 등과 관련하여 생후 초기 저혈당 발현 및 혈당 요동의 위험성이 크다. 본 연구는 심각한 건강문제를 가지고 있지는 않으나 경미한 건강문제로 인해 적극적 임상관찰을 요하는 대상자를 저위험신생아 코호트 집단으로 적시한 후 후향적 의무기록 검토를 통해 이들의 생후 24시간 혈당변이와 영향요인을 탐색하였다.
그 결과 이들의 생후 첫 24시간 혈당값은 60~80 mg/dL 범위 안에서 관찰되었는데, 이는 정상만삭아의 첫 24시간 혈당값[5]과 유사하였다. 이 값에 영향을 주는 요인을 분석한 결과 다음의 주요한 결과가 도출되었다.
첫째, 제왕절개 출생아는 생후 직후뿐 아니라 생후 24시간 동안 매우 불안정한 혈당변이 양상을 보일 확률이 크다. 제왕절개 출생이 혈당변이 및 저혈당 발생에 영향을 주는 요인이라는 결과는 선행 연구에서 제왕절개 출생아의 저혈당 발생 위험도가 정상분만아에 비해 2~4배가량 높았음을 보고한 것과 같은 결과였다[19,20]. 그러나 제왕절개 방법으로 출생하였다고 해서 생후 초기 혈당변이 양상에 영향을 준다고 단정지을 수 없다. 일반적으로 제왕절개 출생은 산모나 태아의 건강문제로 인해 정상분만이 어려운 경우 선택되는 방법이므로 조산, 모체고혈압, 태아가사 등의 문제가 혼재되어 있을 가능성을 배제할 수 없기 때문이다[14]. 한편, 부적정출생 체중아는 AGA 신생아에 비해 생후 24시간 동안 지속적으로 낮은 혈당값을 보였다. 본 연구 결과에서 부적정출생 체중은 혈당변이 양상 자체와 유의한 상호작용을 하는 변수로 관찰되지는 않았으나 AGA 신생아에 비해 지속적으로 낮은 혈당값을 보이는 현상은 부적정출생 체중이 생후 초기 혈당안정에 부정적 영향을 줄 수 있음을 알 수 있는 대목이다[21].
둘째, 심각한 병리문제는 없지만 후기조산, 호흡불안정과 같은 임상적 저위험요인을 가진 신생아는 생후 24시간 동안의 혈당변이 양상이 불안정할 수 있다. 신생아는 생후 초기에 글리코겐과 지방을 주 에너지원으로 사용하는데 이는 대부분 임신후기에 합성되어 간이나 골격근, 지방조직에 저장된다[1,2]. 그러나 조산아의 경우 임신후기를 충분히 채우지 못하고 출생하여 만삭아에 비해 체내에 저장된 글리코겐이 부족할 뿐 아니라 지방축적 또한 충분치 못하여 생후 초기 혈당적응이 적절하게 이루어지지 않을 수 있다[22-24]. 본 연구에서도 후기조산아의 혈당은 생후 2시간 이내에 평균 53.5 mg/dL로 만삭아(71.0 mg/dL)에 비해 현저히 낮은 값을 보였고, 이후 지속적으로 높아져 생후 12시간에는 평균 68.1 mg/dL 수준에 이르렀다. 그 결과, 생후 첫 24시간 동안의 혈당 변화 폭은 만삭아(63.6~78.7 mg/dL)에 비해 후기조산아(53.5~77.1 mg/dL)가 크게 나타났다.
호흡문제는 포도당의 사용을 증가시키고 생성을 감소시키는 데에 영향을 줌에 따라[25] 저혈당 발생에 대한 관련 요인의 상당한 비중을 차지하는 것으로 잘 알려져 있다[17]. 본 연구에서 호흡이 불안정한 집단과 그렇지 않은 집단의 혈당값은 생후 2시간 이내와 생후 24시간 경에는 비슷한 값을 나타내었다. 그러나 두 시점 사이에 호흡이 불안정한 집단의 혈당값은 반대 집단에 비해 큰 폭으로 상승한 후 빠르게 감소와 증가를 반복하는 패턴을 보인 반면, 호흡이 안정적인 집단은 생후 24시간 동안 혈당값이 안정적으로 상승하는 양상을 나타내었다. 이는 호흡불안정과 같은 위험요인이 저혈당이나 병리적 임상증상을 발현할 정도의 가시적인 수준이 아니어도 생후 혈당안정에는 부담으로 작용함을 보여준다. 이에 간호현장에서 간호사는 후기조산이나 경미한 호흡불안정과 같은 저위험요인을 가진 신생아의 혈당값을 보다 적극적으로 관찰하고 이들의 수유를 격려할 필요가 있다.
모체의 임신성고혈압은 생후 초기 혈당안정에 부정적 영향을 줄 수 있다. 모체가 임신기간 동안 지속적으로 비효율적 대사를 경험하는 것은 신생아의 초기 혈당적응에 부정적 영향을 준다[26]. 특히 임신성고혈압은 모체의 말초혈관저항을 높이고 간문막 대사기능을 떨어뜨리며, 태아의 영양공급과 배설에 관여하는 혈액순환에 지속적 장애를 초래하여 신생아저혈당 발생의 위험도를 증가시키는 요인이다[27]. 본 연구에서도 임신성고혈압을 경험한 신생아가 생후 24시간 동안 불안정한 혈당변이를 보이는 것이 관찰되었으나 통계적 유의수준에는 미치지 못하였다. 이때 유의할 부분은 오히려 임신성당뇨를 경험한 신생아의 혈당은 안정적 패턴을 보였다는 점이다. 이는 저위험요인을 가진 신생아라 해도 간호사가 그 위험요인의 속성을 분명히 인지하고 적극적 모니터링과 적절한 중재를 제공하는 경우엔 그 이상의 병리적 현상을 발현하지 않음을 의미한다. 이에 간호사는 신생아 혈당관리에 있어 임신성 당뇨뿐 아니라 모체의 고혈압 역시 중요한 저위험요인으로 간주하여 생후 초기의 혈당적응과 저혈당 임상증상 발현에 대해 면밀히 관찰할 필요가 있다.
셋째, 저위험신생아의 약 1/3은 생후 24시간 동안 저혈당을 경험하는 것으로 나타났다. 이는 재태기간 38주 이하 신생아에서 약 40%의 저혈당을 보고한 연구[18]와 유사한 결과이다. 이때의 평균 혈당값은 37.6mg/dL로 태내에서의 안정적 수준에 비해 50% 이상 낮아진 값이므로 결코 간과할 수 없다. 물론 저혈당 빈도는 1회에 불과하였으나 본 연구의 자료 수집 간격이 최소 2시간에서 6시간임을 고려할 때 한 번 측정된 저혈당이 얼마나 지속되었는지는 알 수 없다. 또한 발생시기 역시 생후 24시간 동안 다양하게 보인다는 점은 저혈당 위험이 생후 24시간 동안 중대하게 존재함을 의미한다.
본 연구에서 저혈당 발현에 영향을 주는 요인을 탐색한 결과, 여아에 비해 남아에게 저혈당이 더 많이 관찰되었고, 고체온을 보인 신생아의 경우 저혈당 빈도가 낮았다. 성별의 경우 본 연구의 결과는 다양한 선행 연구에 의해 밝혀진 사실과 일치하였다[28,29]. 성별이 어떠한 기전에 의해 저혈당의 관련 요인이 될 수 있는지에 대해서는 정확히 밝혀진 바가 없으나, 일부 연구에서는 남아의 테스토스테론이 인슐린의 분비를 증가시켜 저혈당이 발생할 수 있으며 또 다른 연구에서는 남아의 경우 케톤과 같은 대체물질의 생산 조절에 어려움이 있기 때문이라고도 보고하였다[30]. 그러나 남아는 저혈당 외에도 조산과 같은 건강문제가 여아에 비해 많이 관찰됨에 따라 저혈당 발현에 있어서 복합적인 영향을 초래하였을 수 있다. 이에 앞으로도 남아에게 내인되어 있는 저혈당 위험요인에 대한 연구가 지속될 필요가 있다. 한편 고체온을 보인 신생아에게서 저혈당 빈도가 낮게 관찰된 점은 선행 연구와 일치하지 않은 새로운 결과였다. 선행 연구에서는 저혈당이 저체온과 같은 스트레스 상황에서 관찰될 수 있고, 고체온일 때에는 조직의 포도당 소모량이 증가함에 따라 간혹 저혈당이 발생할 수 있다고 보고하였다[1]. 차후 고체온과 저혈당 간의 기전 역시 좀더 탐색할 필요가 있다.
결 론
본 연구 결과 저위험신생아의 혈당은 생후 24시간 동안 평균 60~80 mg/dL 범위에서 증가하는 양상을 보였다. 그러나 신생아가 가지고 있는 저위험요인 중 제왕절개, 다태아, 부적정출생 체중, 저출생 체중, 후기조산, 호흡불안정을 보이는 신생아는 생후 2시간에 낮은 혈당값을 보이므로 생후 초기 적극적 구강수유를 격려하는 것이 매우 중요하다. 또한 저위험신생아의 약 1/3은 생후 24시간 동안 저혈당을 경험하므로 이들의 혈당을 보다 면밀히 측정하고 저혈당 증상을 관찰하는 것이 필요하며 안정적인 혈당 패턴을 위해 조기수유 격려가 필요함을 지지한다. 생후 첫날은 가장 불안정한 상태이면서도 적극적 구강수유를 통해 혈당안정을 도모해야 하는 시기이다. 본 연구는 생후 첫날 혈당값의 범위뿐 아니라 임상 특성과 혈당변이 간의 관계를 제시하였다. 간호사는 이를 바탕으로 병리적 문제는 없으나 일시적이고 경미한 생후적응 문제가 있는 신생아에게 적절한 구강수유를 격려하고, 혈당소모를 증가하는 임상증상을 보다 면밀히 관찰하여 저혈당을 예방하며, 필요 시 생후적응 문제 여부에 따라 혈당적응이 적절한 패턴으로 이루어지고 있는지 확인할 수 있는 임상지침을 개발할 필요가 있다.
한편 본 연구는 다음과 같은 세 가지의 제한점을 갖는다. 첫째, 후향적 자료 조사연구 설계로 인해 요인 간의 중복이나 축적효과를 확인할 수 없었던 점이다. 예를 들어 제왕절개, 다태아, 부적정 출생 체중, 저출생 체중, 후기조산, 모체의 당뇨와 고혈압 등의 임상적 특성이 생후 초기 혈당변이에 어떤 가중효과를 가지는지는 알 수 없다. 둘째, 역시 후향적 코호트연구로 진행함에 따라 일부 요인의 기록은 상호 일관성을 보증할 수 없었으며, 100% 가용하지 않은 경우 제외하였다. 이에 코호트 집단의 구성원이나 집단 내 연구 변수의 대표성을 확보할 수 없었다. 추후 전향적 연구 설계, 저위험요인에 대한 조작적 정의 등을 통해 자료 수집 변수 설정과 수집의 신뢰도와 타당도를 향상시킬 필요가 있다. 셋째, 본 연구에서는 통계적으로 5% 이내의 유의성이 충족되지 않으나 임상적으로 의미가 있는 경우 해석에 포함하였다. 후속 연구에서는 저위험 신생아의 저혈당 관련 요인에 대해서 표본의 크기를 증대하여 조사해 볼 필요가 있다.
Notes
No existing or potential conflict of interest relevant to this article was reported.