서 론
연구의 필요성
영아의 영양 중재는 소아중환자 간호의 중요한 부분으로, 성인에 비해 당 이용 능력이 낮은 영아의 성장, 발달과 수술 후 빠른 회복을 위해서는 적절한 영양 중재가 필수적이다[1,2]. 금식과 총정맥영양 주입 상태의 장기화는 소화기계 점막의 위축을 유발하고[3], 불충분하거나 지연된 영양 공급은 영아의 성장 지연과 관련될 수 있으며, 특히 인공 호흡기 제거 및 수술 후 회복 과정에 결정적인 영향을 미친다[1,4].
선천성 심질환 영아는 심부전 또는 호흡부전으로 인해 수술 전 금식이 흔하며 정상 아동보다 성장이 지연되어 있으므로[5] 수술 후 보다 적극적인 영양 중재가 필요하다. 그러나 심장수술 후 불안정한 활력징후, 인공기도 제거, 흉관 및 중심정맥관 삽입 등의 빈번한 침습적 시술, 유미흉(chylothorax)과 같은 금식이 불가피한 합병증의 발생, 그리고 수유내성으로 인한 수유중단 등으로 중환자실 입원기간 동안 충분한 영양공급을 받는 영아는 48.4%에 불과하다[6-8]. 좌심형성부전증후군(Hypoplastic Left Heart Syndrome, HLHS)의 장관 혈류(mesenteric flow) 이상과 관련된 괴사성 장염(necrotizing enterocolitis) 발생의 높은 위험성[8], 고식적 수술 후 체혈류량(systemic blood flow)과 폐혈류량(pulmonary blood flow)의 불균형과 영양장애와의 관련성[9]과 같은 선천성 심질환아 고유의 혈역학적 특징이 장관영양 진행에 영향을 미친다. 또한 위장관계 혈류에 부정적 영향을 미치는 특정 혈관수축제와 강심제[10]의 지속주입으로 인해 수술 후 장관영양이 제한되기도 한다.
장관영양 진행에 어려움이 있는 대상자들에게 표준화된 장관영양 프로토콜의 적용이 총정맥영양 주입기간과 목표 수유량 도달까지의 기간을 단축시키고, 위장관계 합병증 발생 및 생존율에도 긍정적인 영향을 미치는 것으로 보고되어[11,12], 최근 여러 의료기관에서 장관영양 프로토콜 적용이 보편화되고 있다[7]. 장관영양 프로토콜의 적용은 간호사들의 수유관련 지식 향상에 긍정적 영향을 미치는데, 잔류량 관리에 대해 정확한 지식을 가진 간호사의 비율이 장관영양 프로토콜 적용 전 42%에서 프로토콜 적용 후 96%로 증가하였다[13]. 또한 의료진들은 프로토콜의 적용이 간단하고 일관성 있는 중재를 가능하게 하며, 신속한 장관영양을 진행하도록 돕는다고 인식하였다[14].
그러나 심장수술 후 영아를 위해 개발된 기존의 장관영양 프로토콜을 그대로 적용하기에는 몇 가지 문제점이 있다. 선천성 심질환아를 대상으로 한 장관영양 프로토콜 대부분이 HLHS로 노우드 술식을 받은 대상자에 국한되어 있고, 혈역학적 안정화에 대한 불명확한 기준으로 인해 언제 장관영양이 시작되어야 하는지가 모호하며, 위장관계 합병증 발생의 위험 요인에 대한 고려 없이 일관된 증량 방법이 제시되었다. 장관영양 시작을 위해서는 혈역학적 안정화가 우선되어야 하는데[15], 일부 선행연구에서 혈역학적 안정화의 기준이 제시되었으나 실제 임상상황이 잘 반영되지 않았다. 예로, del Castillo 등[16]은 장관영양 시작의 금기증으로 특정 강심제의 지속투여 및 약물이 감량되지 않는 상태를, Braudis 등[17] 은 장관영양 시작을 위한 혈역학적 안정화에 대한 기준으로 소량의 강심제 투여 및 적절한 말초혈관 관류를 기술하였으나, 실제 소아중환자실에서는 더 다양하고 고용량의 심혈관계 약물들이 투여되고 있는 상태에서 장관영양이 진행되고 있으므로 일부 심혈관계 약물의 지속주입 여부가 혈역학적 안정화의 기준이 되는 것은 부적절하다. 또한 Davis 등[18]에 수행된 완전교정술과 고식적 수술(palliative operation)을 받은 영아의 비교연구에서 동일한 시기에 장관영양이 시작되더라도 고식적 수술을 받은 영아는 완전교정술을 받은 영아에 비해 목표 수유량에 도달하는 데 2배 이상의 시간이 소요되었고, 수유 관련 합병증 발생률이 유의하게 높았다는 결과(48% vs 4%)는 장관영양 진행에 있어 영아의 진단 및 수술방법에 따른 혈역학적 특징이 반영된 장관영양 프로토콜 개발의 필요성을 제시한다.
본 연구가 시행된 소아중환자실은 표준화된 장관영양 프로토콜의 부재로 인해 일관적이지 않는 영양 중재에 대한 문제가 제기되어 왔고, 다양한 혈역학적 특징을 가지는 심질환 영아에게 적용 가능한 장관영양 프로토콜 개발에 대한 필요성이 대두되었다. 이에 본 연구는 지속 주입되는 강심제의 총합을 이용한 강심제 점수(vaso-active inotropic score)가 심장수술을 시행한 영아의 수술 후 인공기도 제거까지의 시간, 중환자실 재원일, 마이너스 체액 평형(negative fluid balance)까지의 시간을 반영하고 중환자실 이환율 및 사망률의 지표가 될 수 있다는 보고[19]와 완전교정술과 고식적 수술 후의 수유성과가 다르다는 결과를[18] 반영하여, 강심제 점수 및 수술 방법에 따라 혈역학적 안정화의 정도를 구분하여 장관영양 시작 및 진행방법을 분류한 장관영양 프로토콜을 개발하여 그 효과를 확인하고자 하였다.
연구 목적
본 연구의 목적은 심장수술 후 소아중환자실에 입원한 영아의 장관영양 프로토콜을 개발하고, 적용 후의 환자의 수유성과(feeding outcome) 및 간호사들의 장관영양에 대한 지식수준을 비교하기 위함이며, 구체적인 연구목적은 다음과 같다.
첫째, 장관영양 프로토콜 적용 전, 후 영아의 목표 수유량 도달기간을 비교한다.
둘째, 장관영양 프로토콜 적용 전, 후 영아의 수유중단 발생률을 비교한다.
셋째, 장관영양 프로토콜 적용 전, 후 영아의 수유관련 합병증 발생률을 비교한다.
넷째, 장관영양 프로토콜 적용 전, 후 영아의 위장운동촉진제(prokinetics) 처방률을 비교한다.
다섯째, 장관영양 프로토콜 적용 전, 후 중환자실 간호사들의 장관영양에 대한 지식수준을 비교한다.
연구 방법
연구 설계
본 연구는 장관영양 프로토콜을 개발하고, 프로토콜 적용 후 수유성과를 확인하기 위한 비동등성 대조군 사후설계(posttest-only design with nonequivalent groups)로 실험군에 대해 3개월간 중재를 시행하였고, 대조군으로 프로토콜 적용 전의 후향적 의무기록 분석이 함께 시행되었다.
연구 대상자
영아
본 연구의 대상자로 영아는 서울특별시에 소재하는 일 상급종합병원에서 선천성 심질환으로 수술 후 소아중환자실에 입실한 환자 중 비위관을 통한 장관영양을 필요로 하는 생후 3개월 이하이면서 체중 5 kg 이하인 영아 중 부모가 프로토콜 적용에 대해 동의를 한 대상을 포함하였다.
장관영양 프로토콜 적용 전, 후 수유 목표량까지의 도달기간에 대한 비교연구의 결과[20]에 따라 효과크기를 확인하였으며, G*power 3.1 프로그램을 이용하여 유의수준 0.05, 검정력 0.8 및 효과크기 0.73으로 하여 전, 후 비교에 필요한 대상자 수는 각각 25명으로 산출되었으나, 질 관리 활동의 제한된 기간으로 인해 프로토콜 적용 3개월 전의 29명을 대조군으로, 적용 후의 22명을 실험군으로 선정하여 분석 및 비교하였다.
연구 도구
수유 목표량 도달기간
수유 목표량 도달기간은 수유 시작일부터 수액보조요법 없이 목표량 100 mL/kg/day를 모유 또는 분유로만 영양 공급받게 되는 날까지의 기간을 측정하여 시간으로 나타낸 값을 의미한다.
수유중단(feeding interruption)
수유중단은 수유중지(feeding discontinuation), 수유지연(delay) 또는 보류(skip)를 포함한다. 수유 중지는 시술, 수술, 호흡 곤란 또는 수유내성 등으로 불가피하게 금식이 처방된 경우를 의미한다. 수유 지연 또는 보류는 인공기도 발관 또는 수유내성으로 인해 장관영양이 일시적으로 지연되거나 보류되는 경우로 정의하였다.
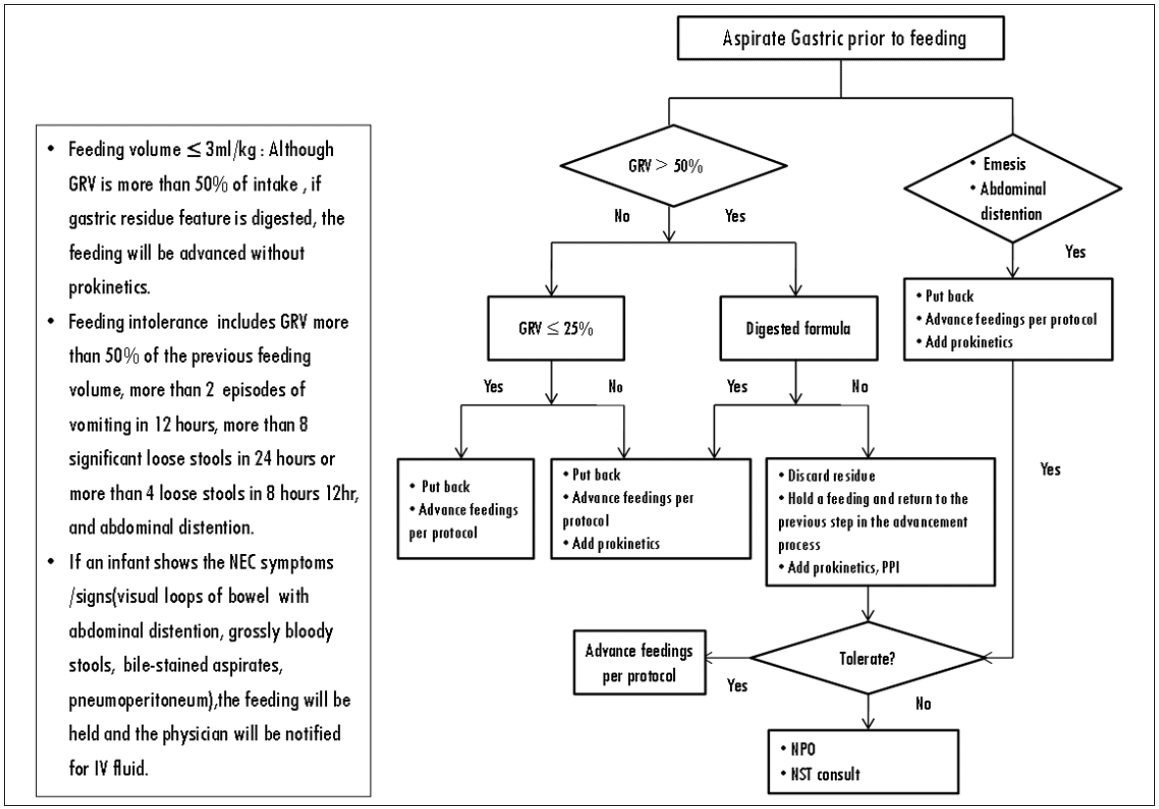
수유관련 합병증
수유관련 합병증은 수유내성(feeding intolerance)과 괴사성 장염의 발생을 포함한다. 수유내성은 소화되지 않은 양상으로 50% 이상의 수유 잔류량, 12시간 동안의 2회 이상의 구토, 위장관계 출혈, 담즙 배액, 복부 팽만, visual loop, 하루 8회 이상 또는 8시간 동안 4회 이상의 묽은 변 중 하나 이상의 증상으로 인해 수유 목표량 도달까지의 기간이 지연되는 경우를 의미한다[21]. 괴사성 장염은 혈변, 담즙 배액, 복부팽만과 함께 진단검사에서 확인된 pneumatosis intestinalis 또는 portal venous air 및 pneumoperitoneum을 동반하는 경우로 정의하였다.
프로토콜 개발 절차
프로토콜이란 한 지역 수준에서 누구에 의해, 무엇이, 언제, 어디에서 수행되어야 하는지에 대한 핵심 질문을 다룸으로써 의료진이 환자를 돌보고 치료하는 단계에서 근거기반의 실무를 가능하도록 하게 하는 기술들로 정의된다[22]. 본 연구에서의 장관영양 프로토콜은 심장 수술 후 소아중환자실에서 간호를 받는 영아를 대상으로 적용되는 비위관 영양에 대한 시작시점, 시작방법, 증량방법, 수유내성 관리에 대한 알고리듬을 포함한다. 장관영양 프로토콜은 문헌고찰을 통한 예비 항목 구성, A병원의 소아영양지원팀(nutrition support team)에 의한 예비항목 검토 및 소아청소년병원의 전문가들에 의한 내용 타당도 평가의 과정을 통해 개발되었다.
1) 영양중재 개발에 대한 요구도 사정: 기존 영양 중재에 대한 문제점을 확인하기 위해 2012년 10-12월까지 3개월 동안 심장수술 후 중환자실에 입실한 영아를 대상으로 수유실태를 분석하였다. 수유 시작시점이 수술 후 1-8일로 다양했고, 시작량도 체중당 0.6-6.7 mL로 일관되지 않았으며, 장관영양 시작시점의 강심제 점수 또한 0-24점까지 넓은 분포를 나타냈다. 2013년 1월 진료과 질관리 담당 교수, 수간호사, 전문 간호사 및 중환자실 간호사로 구성된 부서 질관리 회의에서 영양 중재가 대상자의 중증도를 고려하지 않고 진행되는 점, 의료진의 중재방법에 대한 이해부족 등 기존 중재에 대한 문제점 및 영양중재 프로토콜 개발에 대한 필요성이 논의되었다. 2013년 5월에 시행된 설문조사(24명)에서 대부분의 간호사가 장관영양 제공이 간호의 중요한 부분이라고 인지하였지만, 1명(4.2%)의 간호사만이 장관영양 방법을 정확하게 안다고 하였고, 10명(41.7%)의 간호사가 수유방법이 일관되지 않다고 응답하였다.
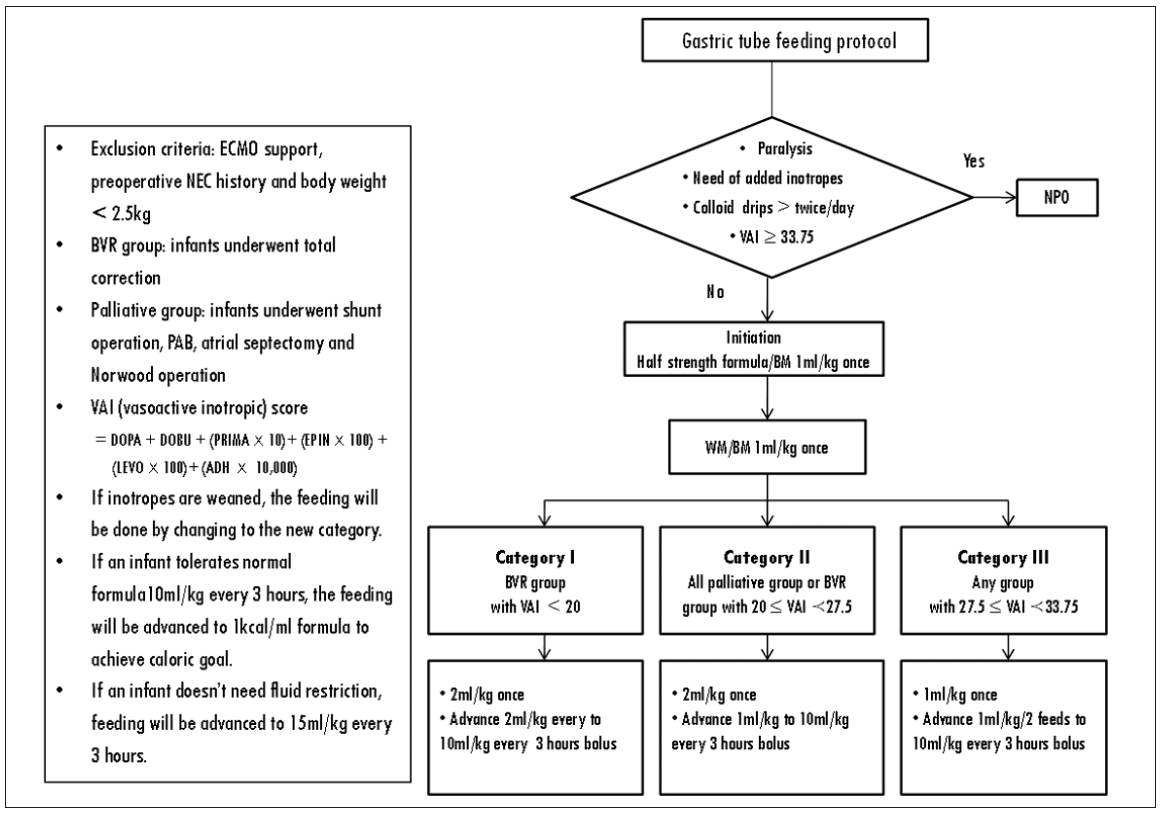
2) 프로토콜 예비항목 개발: 소아 심장수술 후 장관영양에 대한 문헌고찰 후 장관영양 시작을 위한 혈역학적 안정화에 대한 기준, 시작방법, 증량방법, 수유내성 관리에 대한 예비항목을 구성하였다. 문헌고찰은 ‘소아중환자실’ 또는 ‘선천성 심질환아’를 대상으로 ‘장관영양’에 대한 체계적 고찰, 실험연구, 유사실험연구 및 비교연구를 포함하였다. 문헌고찰 결과에 따라 장관영양의 진행에 있어 고려할 요인으로 수술방법과 강심제 점수를 선택하였고, 수술 방법으로 완전교정술과 고식적 수술을 받은 대상자로 구분하여 고식적 수술을 시행받거나 강심제 지속 주입 정도가 많을수록 천천히 수유를 진행하도록 하였다. 강심제 점수(VAI score)는 혈역학적 안정화를 나타내는 지표로 선천성 심질환으로 수술 받은 환아의 수술 후 합병증의 예측인자이며 장관영양의 시작기준이 된다. 수유시작 시점에 투여 중인 강심제의 합으로 공식은 다음과 같으며[19], 32.75점을 기준으로 혈역학적 불안정으로 간주하였다.
VAI score = dopamine dose (mcg/kg/min) + dobutamine dose (mcg/kg/min) + 100 x epinephrine dose (mcg/kg/min) + 10 x milrinone dose (mcg/kg/min) + 100 x norepinephrine dose (mcg/kg/min) + 10,000 x vasopressin dose (U/kg/min)
3) 전문가 타당도 및 최종 프로토콜 개발: 문헌고찰을 기반으로 작성된 프로토콜의 예비항목에 대해 A병원의 소아영양지원팀의 검토를 받은 후, 소아청소년병원의 전문가 10인(소아심장외과, 소아중환자과, 소아심장과, 소아소화기내과의 전문의 4인, 소아임상영양사 1인, 소아임상약사 1인, 신생아 및 소아중환자 임상전문간호사 3인, 소아중환자실 수간호사 1인)에 의해 내용 타당도를 검토 받았다. 내용 타당도 문항은 예비 항목 중 장관영양 시작시점에 관한 2문항, 시작방법에 관한 2문항, 증량방법에 관한 3문항, 수유내성 관리에 관한 8문항, 총 15문항으로 구성하였고, 타당도 지수(Content Validity Index, CVI)를 산출하여 내용 타당도 지수 0.8 미만인 항목 6문항(시작방법 2문항, 잔류량 관리 3문항)을 제거한 후 선별된 항목을 기반으로 하여 최종 프로토콜을 개발하였으며, 최종 알고리듬에 대한 S-CVI는 .98이었다.
최종 프로토콜은 장관영양 진행 및 수유내성 관리 두 영역으로 구분하여 알고리듬 및 간호사들이 숙지해야 할 내용으로 구성하였으며, 중환자실 침상 옆에 비치하여 실무 중 간호사들이 용이하게 사용할 수 있는 형태로 제작하였다.
장관영양 진행영역은 수유진행 알고리듬과 장관영양 금기증 및 적응증, 강심제 점수 산출 방법 등의 내용을 포함하였고, 수술방법 및 강심제 점수에 따라 category 1, 2 및 3으로 분류하여 증량방법을 구분하였다. 수유내성 관리영역은 수유내성 알고리듬과 잔류량 관리, 수유 관련 합병증의 증상 및 징후를 포함하였다(Figure 1, 2).
4) 프로토콜 적용 및 실무적합도 조사: 프로토콜 적용 전 중환자실 의료진을 대상으로 프로토콜 적용에 대한 부서 공지 및 개별교육이 시행되었으며, 프로토콜 적용 후 간호사들의 실무 적합도를 측정하였다. 실무적합도 문항의 구성[23] 및 내용은 문헌고찰을 통해 본 연구자들이 개발하였다. 항목 적합성 10문항, 사용 용이성 4문항, 정확성 4문항, 신속성 1문항, 지적 만족도 1문항, 구성의 적절성 1문항으로 총 21문항, 4점 척도로 구성하였다. 소아병동 근무경력 10년 이상의 책임간호사 1인, 수간호사 1인 및 임상전문간호사 1인이 내용 타당도를 검토하였다. 장관영양 프로토콜 실무적합도에 대한 Cronbach’s α=.85였다.
최종 프로토콜 사용에 대한 간호사들의 실무적합도의 총 평균은 3.0±0.2로 정확성이 3.1±0.3, 항목 적합성이 3.0±0.2로 높게 측정되었고, 구성 적절성 2.7±0.6, 지적 만족도는 2.8±0.6으로 가장 낮게 측정되었다.
자료수집 방법
장관영양과 관련된 요인 및 수유성과
본 연구에서 실험군의 자료수집은 프로토콜 개발 후 2013년 7-9월 동안 성별, 체중, 수술 시 연령, 진단 및 수술방법, 수유에 영향을 미치는 요인(지연봉합, 복막투석, 근이완제 사용, 강심제 점수), 장관영양 관련 변수(시작시점 및 적용방법, 목표량 도달기간, 위장운동 촉진제 투여 여부, 중환자실 재원일수, 수유중지, 수유지연 또는 보류, 수유내성 및 괴사성 장염 발생 여부)를 전향적으로 관찰하여 자료 조사지에 기입하였다. 프로토콜 적용 전의 대조군의 자료수집은 2012년 10-12월 동안 수술한 대상자들의 의무기록과 소아심장외과의 데이터베이스를 이용하여 후향적으로 수집 및 분석하였다.
연구 결과
대상자들의 일반적 특성
프로토콜 적용 전, 후 영아 두 그룹의 연령, 체중, 성별, 체외순환사용 유무, 체외순환 시간, 수유 시 강심제 점수, 지연봉합 유무, 복막투석 유무, 근이완제 사용 유무, 복잡성 질환 정도 비율의 유의한 차이는 없었다(Table 1).
프로토콜 이행을 살펴보았을 때, 비위관으로 목표량까지 장관영양이 진행된 22명의 대상자 중 18명이 완전히, 4명은 부분적으로 프로토콜이 적용되었으며, 8명이 category 1으로, 14명은 category 2로 적용되었다. 프로토콜 적용 후 장관 영양은 수술 후 4 (2-15)일에 시작되었고, 중환자실 재원일 수는 8.5 (4-63)일로 프로토콜 적용 전과 유사하였다.
장관영양 지식에 대한 설문조사에 참여한 간호사는 19명으로, 모두 여성이었으며 기혼자가 5명(21.6%)으로 조사되었다. 교육수준으로는 1명이 전문학사였고, 6명(31.6%)이 석사학위 취득자 또는 재학 중이었으며, 나머지는 학사였다. 간호사들의 A 병원에서의 총 임상경력은 83.2±65.1개월이었다.
목표 수유량 도달기간
목표 수유량 도달기간은 프로토콜 적용 전 56 (27-210)시간에서 적용 후 28.5 (10-496)시간으로 통계적으로 유의하게 단축되었다(Z = -4.22, p<.001) (Table 2).
수유중단 발생률
금식 처방에 의해 수유가 중지된 경우는 프로토콜 적용 전 9명(31.0%)에서 적용 후 1명(4.5%)으로 통계적으로 유의하게 감소하였다(χ2=5.57, p =.030). 수유지연 또는 보류의 발생은 24명(82.8%)에서 13명(59.1%)으로 감소하였으나 통계적 유의성은 없었다(Table 2).
프로토콜 적용 전 금식 처방에 의해 수유가 중지된 9명 중 8명(88.9%)이 심각한 수유내성으로 인해 수유가 중지되었다. 수유지연 및 보류가 발생한 24명의 원인을 살펴보았을 때 16예(66.7%)에서 인공기도 제거 및 인공기도 제거 후의 호흡 곤란으로, 15예(62.5%)에서 수유내성으로, 4예(16.7%)에서 시술 및 재수술로 인해 장관영양이 늦어지거나 일시적으로 중단되었으며, 특히 수유내성으로 인한 지연 및 보류가 발생한 영아 15명 중 9명(60.0%)이 결국 수유가 중지되었다. 프로토콜 적용 후 수유지연 및 보류가 발생한 13명의 원인은 7예(53.8%)에서 인공기도 제거 및 인공기도 제거 후 호흡곤란으로, 7예(53.8%)에서 수유내성으로, 1예(7.7%)에서 시술 및 재수술 때문이었으며, 심각한 수유내성으로 금식이 불가피했던 1예(7.7%)에서만 수유중지가 있었다.
수유관련 합병증 발생률
수유내성은 프로토콜 적용 전 14명(48.3%)에서 적용 후 6명(27.3%)으로 감소하였으나 통계적인 유의성은 없었다. 프로토콜 적용 전, 후 두 그룹 모두 괴사성 장염의 발생은 없었다(Table 2).
수유내성의 양상은 프로토콜 적용 전 14명의 영아에게서 초과 잔류량 12예, 복부팽만 2예, 구토 2예, 담즙배액 2예가, 프로토콜 적용 후 6명의 영아에게서 초과 잔류량 6예, 답즙 배액 1예, 출혈 1예가 한가지 이상의 양상으로 나타났다.
위장운동 촉진제 처방률
위장운동 촉진제가 투여된 경우는 프로토콜 적용 전 20건(69.0%)에서 적용 후 9건(40.9%)으로 경계적으로 유의하게(marginally significantly) 감소하였다(χ2 = 4.01, p =.053) (Table 2).
장관영양에 대한 지식수준
프로토콜 적용 전, 후 장관영양에 대한 지식수준의 비교 결과 증량 방법에 대한 지식이 3.0 (2.0-4.0)에서 4.0 (2.0-5.0)으로(Z = -3.07, p = .002), 시작기준에 대한 지식이 3.0 (2.0-4.0)에서 4.0 (2.0-5.0)으로(Z = -2.95, p =.003) 가장 크게 증가하였고, 수유내성에 대한 지식이 3.0 (2.0-4.0)에서 4.0 (3.0-4.0)으로(Z = -2.31, p = .021) 통계적으로 유의하게 증가하였다(Table 3).
논 의
심장수술 후 대부분의 영아는 인공기도 제거 후 조기 장관영양이 가능하지만, 일부 복잡성 심질환 영아는 인공호흡기 치료가 연장되어 중환자실 재원기간 동안 총정맥영양 또는 장관영양이 필수적이다. 본 연구는 심장수술 후 영아를 위한 표준화된 장관영양 프로토콜이 수유성과에 미치는 영향을 확인하기 위한 소규모의 성과연구이다.
장관영양 프로토콜을 적용한 그룹에서 수유관련 합병증 발생의 증가 없이 목표량까지의 도달기간이 단축되었고, 수유가 중지된 경우가 감소하였다. 이와 같이 결과는 장관영양 프로토콜의 적용이 총정맥영양에 대한 의존을 감소시키고 목표 수유량까지의 도달기간을 단축시키며, 구토 발생 감소 등 원활한 수유진행을 돕는다는 선행연구의 결과[20,24]와 일맥상통한다. 본 연구 결과 프로토콜 적용 전 수유내성이 발생한 9명 중 8명의 영아가 수유가 중지되었지만, 프로토콜 적용 후에는 오직 1명의 영아만 수유내성으로 인해 금식이 불가피하였다. 이는 수유내성 관리 알고리듬에서 이전 수유량의 50%까지를 잔류량으로 허용하였고, 영아가 소화시키지 못한다면 1회 보류 후 감량하여 진행함으로써 가능한 장관영양을 지속하도록 유도한 결과로, 잔류량으로 인한 수유중단 발생의 감소가 목표 수유량까지의 도달기간을 단축시킨 것으로 해석된다. 장관영양 프로토콜에서 수유내성의 양상으로 잔류량에 대한 기준은 연구마다 다양하게 기술되어 있으나[11,21], 본 연구를 통해 소화된 양상의 잔류량 50%의 허용은 심장수술 후 영아에 안전하게 적용될 수 있을 것으로 판단된다. 통계적 유의성은 없었으나 28% 이상 위장운동 촉진제의 사용 빈도가 감소한 것은 수유내성의 정의를 명시화하고, 허용 잔류량을 50%로 상향 조정한 것과 관련성이 있을 것으로 판단되며, 향후 더 많은 프로토콜 적용 대상자들의 분석이 필요하다.
프로토콜 적용 후 수유내성 및 괴사성 장염 등의 수유관련 합병증 발생이 증가하지 않았다. 혈역학적으로 위장관계 혈류 불균형(mesenteric hypoperfusion)의 위험이 있는 단락 의존성 질환인 HLHS 영아의 괴사성 장염의 발생률은 18%까지 보고되었고, 이로 인한 사망률은 25%에서 97%까지 이른다[25]. 이러한 위중한 장관합병증 발생의 위험으로 인해 심장수술 후 혈역학적 안정화가 된 후 장관영양이 시작되어야 한다고 권고되고 있지만 이에 대한 기술은 구체적이지 않았다[15]. 이에 본 연구에서는 강심제 점수를 혈역학적 안정화에 대한 기준으로 하여 보완하였다. 일부 고용량의 심혈관계 약물의 투여가 장관영양을 제한할 것이라는 우려가 있지만, 심혈관계 약물의 사용 정도가 영아의 수유성과에 미치는 영향은 명확하지가 않다. 심혈관계 약물의 지속주입이 심각한 위장관계 합병증의 발생 없이 장관영양 진행을 가능하게 한다는 연구결과가 있으나[26], vasopressin 및 epinephrine과 같은 약물은 내장 혈류량(splanchnic blood flow)을 저해하므로[10] 장관영양 진행을 위해 심혈관계 약물주입 정도가 고려되어야 한다. 기존 장관영양 프로토콜에서는 이러한 심혈관계 약물주입 정도에 따른 장관영양의 시작 가능 여부 및 진행 방법에 있어서의 명확한 기준이 부재하였다. 선행연구에서 혈역학적 안정화에 대한 기준으로 소량의 강심제 사용을[17], 이와 유사하게 dopamine 또는 dobutamine 5 mcg/kg/min 이상, milrinone 0.5 mcg/kg/min, 그리고 지속주입 약물이 감량되지 않는 상태를 수유의 금기사항으로[16] 기술하고 있을 뿐이다. 본 연구의 장관영양 프로토콜에서는 선행연구에서 언급된 약물보다 고용량이 투여되는 상태인 강심제 점수 11.5 (3-23)점에서도 수유가 안전하게 그리고 신속하게 진행되었다. 또한 증량방법에서도 고식적 수술 여부와 강심제 점수를 이용하여 혈역학적 안정화 정도에 따라 3가지 그룹으로 분류하여 목표량까지의 수유를 진행하도록 하였다. 이에 따라 HLHS와 같은 일부 환자군만이 아닌 심장수술 후 다양한 혈역학적 특징을 가지는 영아를 포괄 할 수 있었고, 위장관계 합병증 발생의 증가 없이 목표 수유량까지 진행할 수 있었던 것으로 판단된다. 본 연구에서 수유내성 발생률은 감소하였으나 통계적 유의성은 없었으며, 장관영양 프로토콜과 수유 내성과의 관련성을 확인하기 위한 반복 연구가 필요하다.
장관영양에 대한 지식의 비교에서 간호사들은 장관영양의 시작기준, 시작량, 증량방법, 목표량, 조기수유의 장점 및 수유내성에 대한 지식이 증가하였다. 이러한 결과는 선행 연구에서 장관영양 알고리듬 적용 후 수유내성에 대한 지식이 향상된 결과[13]와 유사하다. 소아중환자실의 장관영양 실태를 분석했을 때 수유 중단은 장관영양에 대한 지연된 처방, 시술 및 인공기도 제거로 인한 금식과 관련되는데[27], 간호사들의 장관영양에 대한 지식의 증가는 영아가 중환자실 치료 중 불가피하게 금식이 필요하더라도 조속하게 장관영양이 재시작될 수 있도록 의료진 간의 원활한 의사소통을 가능하게 함으로써 결과적으로 수유중단을 감소시키고, 수유 목표량까지의 시간을 단축시킬 수 있다. 수술 후 질적 간호를 제공하기 위해 적절한 프로토콜을 개발하는 것은 중요하며[28], 특히 장관영양에 대한 의사결정에 간호사들이 적극적으로 포함되는 것은 환자의 회복시간과 입원기간에 긍정적인 영향을 미친다[29]. 영양 중재를 제공하는 실무자들의 장관영양에 대한 태도 및 지각에 대한 조사는 수유진행과 관련된 다양성과 제한점을 확인할 수 있으므로[27], 실무자들의 장관영양에 대한 의견이 반영될 수 있는 체계가 마련되어야 할 것이다.
특히 선천성 심질환 영아는 수술 전 영양결핍이 있고, 수술 후의 혈역학적 불안정성, 호흡 부전 및 각종 시술로 인해 금식이 요구되는 경우가 많으므로 소아 심장외과 전문간호사는 이들의 영양평가를 통해 적절한 영양 중재를 적시에 적용하고, 환자군의 특성이 적절히 반영된 효과적인 장관영양 프로토콜의 개발을 위해 소아집중영양팀과 협업을 지속해야 할 것이며, 이러한 표준화된 영양 프로토콜의 적용 및 평가는 간호성과의 일환으로 이용될 수 있겠다[30].
혈역학적 안정화의 기준으로 수술방법 및 강심제 점수를 이용한 장관영양 진행 그리고 소화된 양상의 50% 이상의 잔류량 허용에 대한 지침을 다른 연구에도 적용할 것을 제언하고, 표준화된 장관영양 프로토콜과 인공호흡기 유치기간, 중환자실 재원일수, 병원감염 및 총정맥영양 기간에 미치는 유용성에 대한 분석이 필요하다.
본 장관영양 프로토콜은 2016년 10월까지 A병원의 소아중환자실에서 보편적으로 적용되고 있으나, 최근 수유 내성 발생률이 높은 노우드 술식 환자들에게 경유문관(transpyloric tube)을 이용한 지속적 주입(continuous feeding) 방법 보완적으로 적용되고 있다. 프로토콜 적용에 대한 평가와 최신의 문헌고찰을 통해 영양중재에 대한 문제점을 주기적으로 확인하고, 문헌고찰 및 다학제적 접근을 통해 프로토콜의 지속적 보완이 요구된다.
본 장관영양 프로토콜의 효과 분석을 위한 추후 연구에서는 타당도 보완을 위해 더 많은 대상자를 포함하고 성향점수 매칭을 시행하여 연구설계의 취약점이 보완되어야 할 것이다.
결 론
강심제 점수 및 수술방법에 따라 증량방법을 구분한 장관영양 진행 및 수유내성 관리를 포함하는 장관영양 프로토콜 적용 후 목표 수유량까지의 도달기간이 단축되었고, 수유중단 발생률이 감소하였으며, 중환자실 간호사들의 영양에 대한 지식이 증가하였다.
본 연구의 장관영양 프로토콜은 심장수술 후 영아의 수술방법과 강심제 점수에 따라 수유시작과 증량방법을 달리 하여 심각한 위장관계 합병증의 발생 없이 안전하게 수유진행이 가능하도록 하였다. 수유내성 관리 알고리듬을 통한 잔류량 관리와 수유관련 합병증에 대한 명확한 기준의 제시는 수유중단 발생을 최소화하여 목표 수유량까지의 원활한 진행을 돕는 결과를 보였다. 또한 장관영양 프로토콜의 적용은 간호사들의 영양중재에 대한 지식을 증진시킴으로써, 영양중재에 대한 소아 중환자실 간호사들의 적극적인 참여를 가능하게 하여 영아의 수유성과에 긍정적인 영향을 미칠 것으로 보인다.
혈역학적 안정화 정도에 따라 수유진행 정도를 달리하고, 수유 내성관리를 포함하는 장관영양 프로토콜의 적용은 선천성 심질환 수술 후 영아의 안전하고 신속한 수유진행을 돕고, 간호사들의 장관영양 지식 함양에 도움이 되는 것으로 판단된다.